Я часто советую девочкам Бактериофаги и у меня не раз спрашивали что это такое, как я к ним пришла , и почему.
Начну с того, что у моих старших детей была подавленная , слабая иммунка. Мы часто болели, настолько что скорая узнавала нас по телефону, а в инфекционке мы были почти прописаны. Порой казалось что это какое-то проклятие и легче уже просто сдохнуть. Когда твой ребёнок болеет без остановки и прыгает уже на 5 антибиотик, бьётся в судорогах от фебрильной температуры 37,5 это адищее... Порой хотелось выть волком на луну... Но они подросли , иммунка угнетаемая ВЧД выправилась, а я набралась опыта сродни мед сестре. Для справки: иммунитет ребёнка к 7 годам в половину меньше чем у взрослого, у подростка после 12 лет - иммунитет практически равен взрослому человеку. Когда у меня родился 3й сын, я была уже матёрая и уверенная в своих силах мать. Но и тогда возникла ситуация со сменой череды антибиотиков. Вот тогда педиатр назначила Фаги. К тому времени доступ в интернет был уже массовым и я изучила что такое Фаги, и как они работают. В кратце: Фаги несколько лет успешно помогают мне обходиться без антибиотиков во многих случаях. Далее я просто скопирую статью которая была мной слегка укорочена. Поскольку некоторые могут таким образом более развёрнуто получить информацию со всеми терминами.
Как действует бактериофаг.
У всех существ, обитающих на земле,есть микроскопические паразиты — вирусы. Есть свои вирусы и у бактерий . Цикл размножения вируса неизменно заканчивается гибелью бактерии, в связи с чем Феликс Д'эрель, придумал специальное название — «бактериофаги», в переводе с греческого — «пожиратели бактерий».
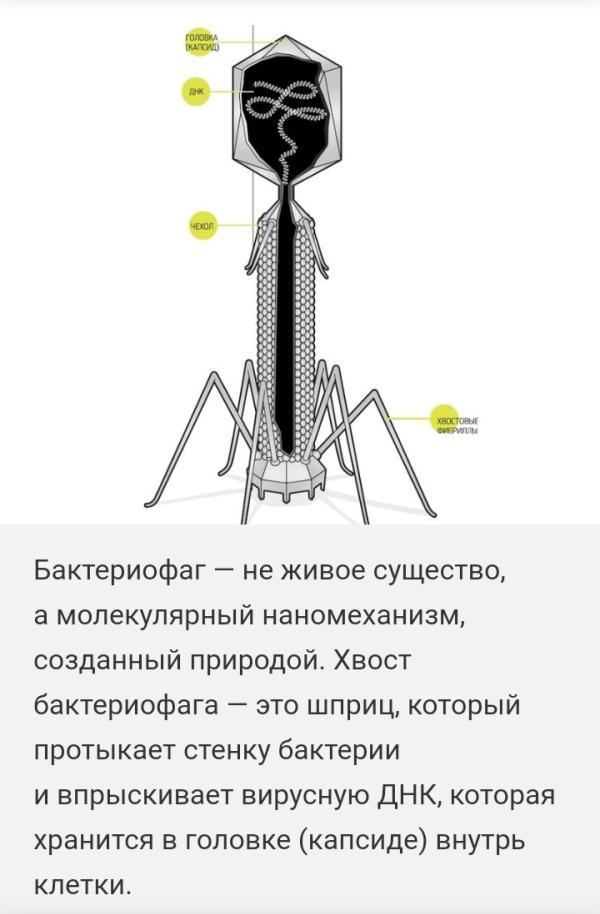
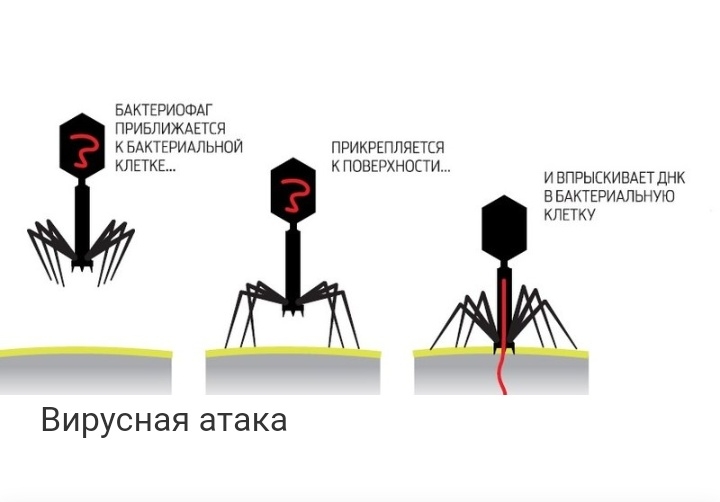
В конце ХХ века стало ясно, что бактерии безусловно доминируют в биосфере Земли, составляя более 90% ее биомассы. У каждого вида имеется множество специализированных типов вирусов. По предварительным оценкам, число видов бактериофагов составляет около 1015. Чтобы понять масштаб этой цифры, можно сказать, что если каждый человек на Земле будет каждый день открывать по одному новому бактериофагу, то на описание всех их понадобится 30 лет. Таким образом, бактериофаги — самые малоизученные существа в нашей биосфере. Большинство известных сегодня бактериофагов принадлежит к отряду Caudovirales — хвостатые вирусы. Их частицы имеют размер от 50 до 200 нм. Хвост разной длины и формы обеспечивает присоединение вируса к поверхности бактерии-хозяина, головка (капсид) служит хранилищем для генома. Геномная ДНК кодирует структурные белки, формирующие «тело» бактериофага, и белки, которые обеспечивают размножение фага внутри клетки в процессе инфекции. Можно сказать, что бактериофаг — это природный высокотехнологичный нанообъект. Например, хвосты фагов представляют собой «молекулярный шприц», который протыкает стенку бактерии и, сокращаясь, впрыскивает свою ДНК внутрь клетки. Бактериофаги для размножения используют аппарат бактериальной клетки, «перепрограммируя» его на производство новых копий вирусов. Последний этап этого процесса — лизис, уничтожение бактерии и освобождение новых бактериофагов.
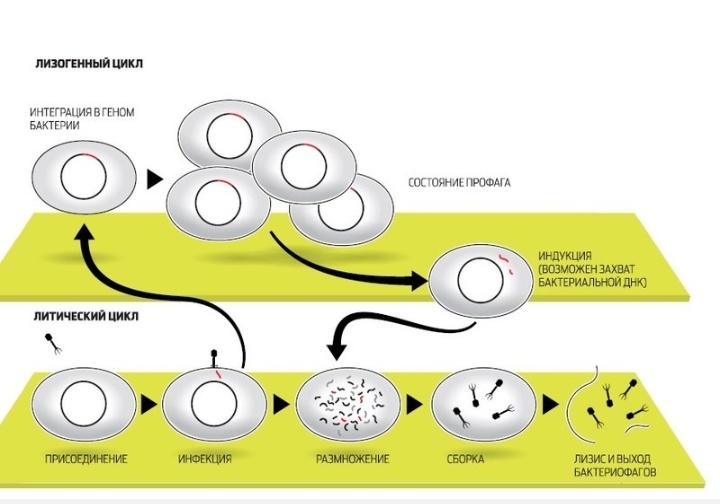
С этого момента начинается инфекционный цикл. Его дальнейшие этапы состоят из переключения механизмов жизнедеятельности бактерии на обслуживание бактериофага, размножение его генома, построение множества копий вирусных оболочек, упаковки в них ДНК вируса и, наконец, разрушение (лизис) хозяйской клетки. У каждого этапа существует множество нюансов, имеющих глубокий эволюционный и экологический смысл. Ведь бактерии и их вирусные паразиты сосуществуют сотни миллионов, если не миллиарды лет. И эта борьба за выживание не закончилась ни тотальным уничтожением одноклеточных, ни приобретением тотальной устойчивости к фагам и бесконтрольным размножением бактерий. Помимо постоянного эволюционного соревнования механизмов защиты у бактерий и нападения у вирусов, причиной сложившегося равновесия можно считать и то, что бактериофаги специализировались по своему инфекционному действию. Если имеется крупная колония бактерий, где своих жертв найдут и следующие поколения фагов, то уничтожение бактерий литическими (убивающими, дословно — растворяющими) фагами идет быстро и непрерывно. Если потенциальных жертв маловато или внешние условия не слишком подходят для эффективного размножения фагов, то преимущество получают фаги с лизогенным циклом развития. В этом случае после внедрения внутрь бактерии ДНК фага не сразу запускает механизм инфекции, а до поры до времени существует внутри клетки в пассивном состоянии, зачастую внедряясь в бактериальный геном. В таком состоянии профага вирус может существовать долго, проходя вместе с хромосомой бактерии циклы деления клетки. И лишь когда бактерия попадает в благоприятную для размножения среду, активируется литический цикл инфекции. При этом, когда ДНК фага освобождается из бактериальной хромосомы, часто захватываются и соседние участки бактериального генома, а их содержимое в дальнейшем может перенестись в следующую бактерию, которую заразит бактериофаг. Этот процесс (трансдукция генов) считается важнейшим средством переноса информации между прокариотами — организмами без клеточных ядер.
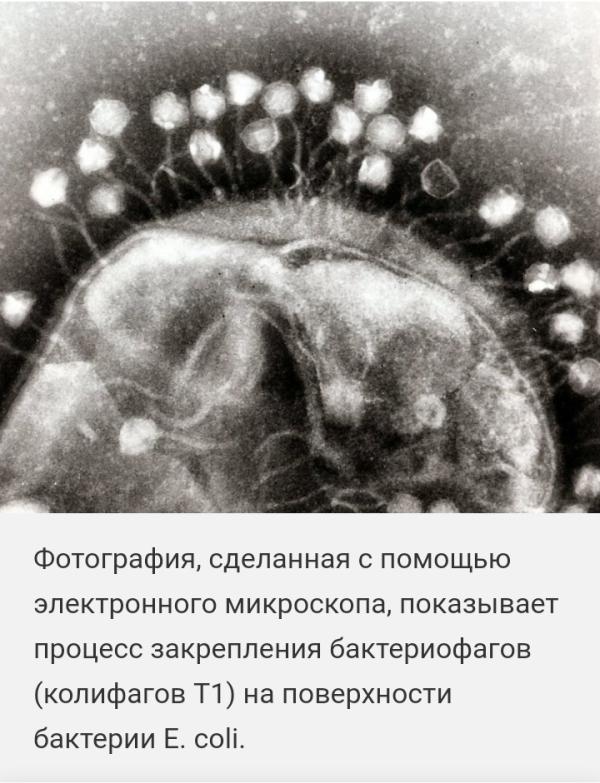
Все эти молекулярные тонкости не были известны во втором десятилетии ХХ века, когда были открыты «невидимые инфекционные агенты, уничтожающие бактерий». Но и без электронного микроскопа, с помощью которого в конце 1940-х впервые удалось получить изображения бактериофагов, было понятно, что они способны уничтожать бактерии, в том числе и болезнетворные. Это свойство было незамедлительно востребовано медициной. Первые попытки лечения фагами дизентерии, раневых инфекций, холеры, тифа и даже чумы были проведены достаточно аккуратно, и успех выглядел вполне убедительно. Но после начала массового выпуска и использования фаговых препаратов эйфория сменилась разочарованием. О том, что такое бактериофаги, как производить, очищать и применять их лекарственные формы, было известно еще очень мало. Достаточно сказать, что по результатам предпринятой в США в конце 1920-х годов проверки во многих промышленных фагопрепаратах собственно бактериофагов вообще не оказалось.
Проблема с антибиотиками
Вторую половину ХХ века в медицине можно назвать «эрой антибиотиков». Однако еще первооткрыватель пенициллина Александр Флеминг в своей нобелевской лекции предупреждал, что устойчивость микробов к пенициллину возникает довольно быстро. До поры до времени антибиотикоустойчивость компенсировалась разработкой новых типов противомикробных лекарств. Но с 1990-х годов стало ясно, что человечество проигрывает «гонку вооружений» против микробов. Виновато прежде всего бесконтрольное применение антибиотиков не только в лечебных, но и в профилактических целях, причем не только в медицине, но и в сельском хозяйстве, пищевой промышленности и быту. В результате устойчивость к этим препаратам начала вырабатываться не только у болезнетворных бактерий, но и у самых обычных микроорганизмов, живущих в почве и воде, делая из них «условных патогенов». Такие бактерии комфортно существуют в медицинских учреждениях, заселяя сантехнику, мебель, медицинскую аппаратуру, порой даже дезинфицирующие растворы. У людей с ослабленным иммунитетом, каких в больницах большинство, они вызывают тяжелейшие осложнения.
Неудивительно, что медицинское сообщество бьет тревогу. В прошедшем, 2012 году гендиректор ВОЗ Маргарет Чен выступила с заявлением, предсказывающим конец эры антибиотиков и беззащитность человечества перед инфекционными заболеваниями. Впрочем, практические возможности комбинаторной химии — основы фармакологической науки — далеко не исчерпаны. Другое дело, что разработка противомикробных средств — очень дорогой процесс, не приносящий таких прибылей, как многие другие лекарства. Так что страшилки о «супербактериях» — это скорее предостережение, побуждающее людей к поискам альтернативных решений.
На медицинской службе
Вполне логичным выглядит возрождение интереса к использованию бактериофагов — естественных врагов бактерий — для лечения инфекций. Действительно, за десятилетия «эры антибиотиков» бактериофаги активно служили науке, но не медицине, а фундаментальной молекулярной биологии. Достаточно упомянуть расшифровку «триплетов» генетического кода и процесса рекомбинации ДНК. Сейчас о бактериофагах известно достаточно, чтобы обоснованно выбирать фаги, подходящие для терапевтических целей
Достоинств у бактериофагов как потенциальных лекарств множество. Прежде всего — это их несметное количество. Хотя изменять генетический аппарат бактериофага тоже намного проще, чем у бактерии, и тем более — у высших организмов, в этом нет необходимости. Всегда можно подобрать что-то подходящее в природе. Речь идет скорее о селекции, закреплении востребованных свойств и размножении нужных бактериофагов. Это можно сравнить с выведением пород собак — ездовых, сторожевых, охотничьих, гончих, бойцовых, декоративных… Все они при этом остаются собаками, но оптимизированы под определенный вид действий, нужных человеку. Во‑вторых, бактериофаги строго специфичны, то есть они уничтожают только определенный вид микробов, не угнетая при этом нормальную микрофлору человека. В-третьих, когда бактериофаг находит бактерию, которую должен уничтожить, он в процессе своего жизненного цикла начинает размножаться. Таким образом, не столь острым становится вопрос дозировки. В-четвертых, бактериофаги не вызывают побочных эффектов. Все случаи аллергических реакций при использовании терапевтических бактериофагов были вызваны либо примесями, от которых препарат был недостаточно очищен, либо токсинами, выделяющимися при массовой гибели бактерий. Последнее явление, «эффект Герксхаймера», нередко наблюдается и при применении антибиотиков.
Две стороны медали
К сожалению, недостатков у медицинских бактериофагов тоже немало. Самая главная проблема проистекает из достоинства — высокой специфичности фагов. Каждый бактериофаг инфицирует строго определенный тип бактерий, даже не таксономический вид, а ряд более узких разновидностей, штаммов. Условно говоря, как если бы сторожевая собака начинала лаять только на одетых в черные плащи громил двухметрового роста, а на лезущего в дом подростка в шортах никак не реагировала. Поэтому для нынешних фаговых препаратов нередки случаи неэффективного применения. Препарат, сделанный против определенного набора штаммов и прекрасно лечащий стрептококковую ангину в Смоленске, может оказаться бессильным против по всем признакам такой же ангины в Кемерове. Болезнь та же, вызывается тем же микробом, а штаммы стрептококка в разных регионах оказываются различны.
Поскольку бактериофагов в природе несметное количество и они постоянно попадают в организм человека с водой, воздухом, пищей, то иммунитет их просто игнорирует. Более того, существует гипотеза о симбиозе бактериофагов в кишечнике, регулирующем кишечную микрофлору. Добиться какой-то иммунной реакции можно только при длительном введении в организм больших доз фагов. Но таким образом можно добиться аллергии на почти любые вещества. И наконец, очень важно то, что бактериофаги недороги. Разработка и производство препарата, состоящего из точно подобранных бактериофагов с полностью расшифрованными геномами, культивированных по современным биотехнологическим стандартам на определенных штаммах бактерий в химически чистых средах и прошедших высокую очистку, на порядки дешевле, чем для современных сложных антибиотиков. Это позволяет быстро приспосабливать фаготерапевтические препараты к меняющимся наборам патогенных бактерий, а также применять бактериофаги в ветеринарии, где дорогие лекарства экономически не оправданы.
Для максимально эффективного применения бактериофага необходима точная диагностика патогенного микроба, вплоть до штамма. Самый распространенный сейчас метод диагностики — культуральный посев — занимает много времени и требуемой точности не дает. Быстрые методы — типирование с помощью полимеразной цепной реакции или масс-спектрометрии — внедряются медленно из-за дороговизны аппаратуры и более высоких требований к квалификации лаборантов. В идеале подбор фагов-компонентов лекарственного препарата можно было бы делать против инфекции каждого конкретного пациента, но это дорого и на практике неприемлемо.
Другой важный недостаток фагов — их биологическая природа. Кроме того, что бактериофаги для поддержания инфекционности требуют особых условий хранения и транспортировки, такой метод лечения открывает простор для множества спекуляций на тему «посторонней ДНК в человеке». И хотя известно, что бактериофаг в принципе не может заразить человеческую клетку и внедрить в нее свою ДНК, поменять общественное мнение непросто. Из биологической природы и довольно большого, по сравнению с низкомолекулярными лекарствами (теми же антибиотиками), размера вытекает третье ограничение — проблема доставки бактериофага в организм. Если микробная инфекция развивается там, куда бактериофаг можно приложить напрямую в виде капель, спрея или клизмы, — на коже, открытых ранах, ожогах, слизистых оболочках носоглотки, ушей, глаз, толстого кишечника — то проблем не возникает.
Но если заражение происходит во внутренних органах, ситуация сложнее. Случаи успешного излечения инфекций почек или селезенки при обычном пероральном приеме препарата бактериофага известны. Но сам механизм проникновения относительно крупных (100 нм) фаговых частиц из желудка в кровоток и во внутренние органы изучен плохо и сильно разнится от пациента к пациенту. Бактериофаги бессильны и против тех микробов, которые развиваются внутри клеток, например возбудителей туберкулеза и проказы. Через стенку человеческой клетки бактериофаг пробраться не может.
Нужно отметить, что противопоставлять применение бактериофагов и антибиотиков в медицинских целях не следует. При совместном их действии наблюдается взаимное усиление противобактериального эффекта. Это позволяет, например, снизить дозы антибиотиков до значений, не вызывающих выраженных побочных эффектов. Соответственно, и механизм выработки у бактерий устойчивости к обоим компонентам комбинированного лекарства почти невозможен. Расширение арсенала противомикробных препаратов дает больше степеней свободы в выборе методики лечения. Таким образом, научно обоснованное развитие концепции применения бактериофагов в противомикробной терапии — перспективное направление. Бактериофаги служат не столько альтернативой, сколько дополнением и усилением в борьбе с инфекциями.



Лучший комментарий
Спасибо вам за такую полезную инфу.😘...я даже и не знала что это🙆
Комментарии
Здравствуйте, скажите пожалуйста, могу я мелкому давать фагио без назначения? Никакие анализы не надо сдавать? Мы болеем уже месяц орви и хрипы в лёгких. Пропили Флемоксин не помог, и ампициллин уколы получили тоже безрезультатно. Уже не знаю что делать. Из 3детской не вылазием((
@asel.dusheeva Здравствуйте я читала где то о Фагио сейчас наткнулась на вас☺У нас кашель в горлешке мокрота врач прописала нечего не помог,она кашляет часто особенно когда спит и этот мокрото не уходит от горло вот думаю дать Фагио то есть купить.Сколько надо брать и сколько можно на 4,месяцу?
@mama2d.com чуть выше мой коммент прочтите ☝️ для вас таже доза. Купите 1 упаковку, там 4 флакона. На курс вам хватит. Если будут вопросы, пишите в личку, отвечу подробно.
@asel.dusheeva конечно понимаю,но как всё успеваете и помочь и дети ваши🤓👍🏼вы герой 💪🏼🤓
@lolita2321 Дети старшие помогают, вот и Лафа у меня, ну почти :)
Асель вы ещё не устали всем отвечать, ещё так от души каждой 🤪😇вы герой прегги! 🤓
Спасибо за полезную информацию, надо уточнить у педиатра нашего 🌷
Спасибо вам за такую полезную инфу.😘...я даже и не знала что это🙆
спасибо большое за информацию,у нас как раз ксшель и насморк.
Хорошая статья 🤗
Я тоже за Фаги.
Фагио, Фагести, Фагестаф.
А Сектсафаг не слышала
@oluwa Да, перерос в 4,5 месяца. Получается как Стафф пролечили ЛН отступила. У вас Генетика С/С ?
@asel.dusheeva
Дааа 😭
Сс показало.
Я не верила. Как так, откуда, в кого !!!
Но ребенку 1.7 и не перерос.
От ложечки молочной каши начинается гусиная кожа по телу, с сухими островками похожими на псориаз (ножки в основном). От капельки творога - срыгивания на 2 дня. На кефир, непереваренные с желтыми хлопьями 💩
Ужааас. И это наверно никогда не закончиться.
и поносы эти хронические. Разжиженная консистенция, плохая перевариваемость и усвояемость.
Говорили "перерастет к году", потом "ну к 1.5 значит". Теперь типа "в 2 наверно перерастет".
Я живу надеждой тк... она умирает последней. Но, уже не жду положительного исхода
@oluwa По идее с ферментом молочку можно. Если у вас в довесок нет КБ, часто читала что сыпет именно когда помимо ЛН есть ещё и КБ.
И вы с моим деткам давали или как это получается вводили их?
@2lions Да, бывало и во время обострения принимали, с отменой антиба при этом.
@aeeda, @asel.dusheeva, спасибо за ответ ) а может вы и посоветуете какой именно фаг стоит принимать во время гнойной ангины
@2lions однозначно сначала курс антибов, а уже как содёт гной или будет рецидив, в самом начале заболевания можно Фагио или Секстафаг.
Эммм такой длинный текст, если честно очень мало чего поняла, это что получается препарат от определенных болезней?
очень интересно👀 я сама должна все изучить 🙌😌 после побеседуем
Я прочла . Теперь вопрос. Если эти Фаги разные, то получается фагио для живота врятли справится с носом 🧐🧐🧐 так чтоль
@vdev в нос какие Антибы прописали? Фаги в носик можно капать щедро, излишек попадёт в горлышко и там поработает за одно. Получается закапапываете сколько не жалко, серьезно , это не Антиб, передоза не будет.
@asel.dusheeva храните в холодильнике, набираете из флакона шприцом стерильным, иголка до конца пользования должна оставаться в резиновой крышечке. Можете пользовать инсулиновый шприц, набирать 0,5 мг и закапывать в носик предварительно согрев лекарство пару минут в руке ( не флакон а шприц с содержимым) .
@asel.dusheeva, меладекс или неладекс ( точно не помню) и називин детский чтоб отек снимать




Спасибо за полезную информацию, надо уточнить у педиатра нашего 🌷